CHIMICA
(da kemà, il libro dei segreti dell'arte egizia, da cui l'arabo "al-kimiaa" "الكيمياء")
La chimica è la scienza che studia la composizione della materia ed il suo comportamento in base a tale composizione.
La chimica è anche stata definita come "la scienza centrale" (in inglese "central science") perché connette le altre scienze naturali, come l'astronomia, la fisica, le scienze dei materiali, la biologia e la geologia.
Oggetti di studio della chimica sono principalmente:
- le proprietà dei costituenti della materia (atomi);
- le proprietà delle entità molecolari, ad esempio ioni o molecole, costituite da singoli atomi o dalla combinazione di più atomi;
- le proprietà delle specie chimiche (ciascuna delle quali caratterizzata da una specifica tipologia di entità molecolare e da particolari proprietà che la distinguono dalle altre specie chimiche);
- le proprietà delle miscele e dei materiali costituiti da una o più specie chimiche.
Tale studio della materia non è limitato alle sue proprietà e struttura in un dato istante, ma riguarda anche le sue trasformazioni, dette reazioni chimiche.
L'atomo e le sue teorie
La materia è tutto ciò che occupa uno spazio. I diversi tipi di materia sono detti: sostanze e composti. Questi ultimi possono essere omogenei ed eterogenei.
La molecola è la parte più piccola di una sostanza che presenta ancora tutte le proprietà della sostanza stessa. Le molecole, a loro volta, si possono dividere in particelle ancora più piccole dette atomi. In natura esistono 92 tipi di atomi diversi che, combinandosi tra loro, danno origine alle varie sostanze. Secondo la teoria atomica di Dalton il modello atomico si fonda sui seguenti postulati:
1) La materia è fatta da particelle microscopiche indivisibilii e indistruttibili detti atomi;
2) In una reazione chimica gli atomi di un elemento non possono essere nè creati e nè distrutti e si trasferiscono interi formando nuovi composti;
L'atomo ha una struttura molto complessa costituita al centro da un nucleo contenente protoni (carica positiva) e neutroni (privi di carica), attorno al nucleo ruotano gli elettroni (carica negativa) su determinate traiettorie. Se gli elettroni e i protoni sono in ugual numero l'atomo è elettricamente neutro (come nei gas nobili).
Il numero dei protoni è detto numero atomico (si indica con Z) mentre col numero di massa si indica il numero dei protoni e dei neutroni.
Il modello di atomo proposto da Rutherford aveva delle caratteristiche che sono rimaste anche in modelli succesivi: la concentrazione della materia in un volume relativamente piccolo rispetto le dimensioni atomiche sta nel nucleo mentre gli elettroni ruotano intorno ad esso come i pianeti del sistema solare attorno al sole. L'atomo dunque sarebbe in gran parte vuoto.
Il campo elettrico si propaga mediante mediante onde. Un onda descrive una curva detta sinusoide caratterizzata da creste (i punti più alti) e avvallamenti o ventri (i punti più bassi). I principali parametri che caratterizzano un'onda sono: ampiezza, cioè la variazione massima dell'oscilazione; lunghezza d'onda data dalla distanza minima fra due creste o due ventri successivi; periodo rappresentato da intervalo di tempo misurati in secondi in cui avviene un'oscilazione completa; frequenza data dal numero di oscillazioni in un secondo misurata in Hertz. La velocità di propagazione di un'onda dipende dal mezzo materiale nel quale l'onda si propaga.
Eletromagnetismo
James Clerk Maxwell (1831-1873) è stato un matematico e fisico scozzese. Propose la prima teoria dell'elettromagnetismo, raggruppò nella sua teoria le sue osservazioni, equazioni ed esperimenti, unificandole con le note equazioni di Maxwell in cui dà un ottimo contributo sia alla teoria cinetica dei gas, sia alla termodinamica statica. Le equazioni di Maxwell dimostrano che l'elettricità, il magnetismo e la luce sono tutte manifestazioni dello stesso fenomeno: il campo elettromagnetico. Propose che la luce visibile è formata da radiazioni elettromagnetiche. Le sue scoperte sono considerate tra le più grandi nel campo della fisica del XIX secolo, Maxwell premia l'analogia, perchè secondo lui si deve dare importanza ai campi della scienza meno conosciuti, partendo dalle leggi che governano fenomeni meglio conosciuti e per Maxwell questo metodo dev'essere usato con consapevolezza di mon vanificare gli sforzi.
Modello atomico di Bohr
Niels Hendrik David Bohr (1885-1962) è stato un fisico, matematico teorico della fisica e accademico danese. Diede contributi fondamentali nella comprensione della struttura atomica e nella meccanica quantistica, per i quali ricevette il Premio Nobel per la fisica nel 1922
Bohr ha realizzato tre postulati:
-1) Gli elettroni si muovono su traiettorie circolari (orbite) ed hanno specifici valori di energia (quanti). Il valore del modulo del momento angolare dell'elettrone che ruota intorno al nucleo dev'essere un multiplo intero della costante di Plank ridotta, di conseguenza l'energia di un elettrone sipwnde solo dal valore del numero quantico principale
-2) Si emette luce quando l'elettrone si muove da un livello di energia più alto e uno più basso. L'atomo irragia energia solamente quando per qualche motivo un elettrone effettua una transizione da uno stato stazionario ad un altro. La frequenza v della radiazione è legata all'energia del livello di partenza e quello di arrivo della relazione:

-3) Nel modello semplice di Bohr il numero atomico è Z, la caroca dell'elettrone è e l'energia potenziale a distanza è: -(kZe^2):r (k è la costante di Coulomb). Quantizza il momento della quantità di moto della particella.
Effetto fotoelettrico
Albert Einstein (1879-1955) è stato un fisico e filosofo tedesco naturalizzato svizzero e statunitense. Einstein:
- dimostrò la validità del concetto di quanto di Planck nell'ambito della spiegazione dell'effetto fotoelettrico dei metalli;
- fornì una valutazione quantitativa del moto browniano e l'ipotesi di aleatorietà dello stesso;
- espose in due articoli la teoria della relatività ristretta, che precedette di circa un decennio quella della relatività generale.
Nel 1921 ricevette il premio Nobel per la fisica per i contributi alla fisica teorica, in particolare per la scoperta della legge dell'effetto fotoelettrico e la sua fama dilagò in tutto il mondo soprattutto per la teoria della relatività.
L'effetto fotoelettrico è il fenomeno fisico caratterizzato dall'emissione di elettroni da una superficie, solitamente metallica, quando questa viene colpita da una radiazione elettromagnetica, ossia di fotoni (particelle di luce) aventi uma certa lumghezza d'onda:
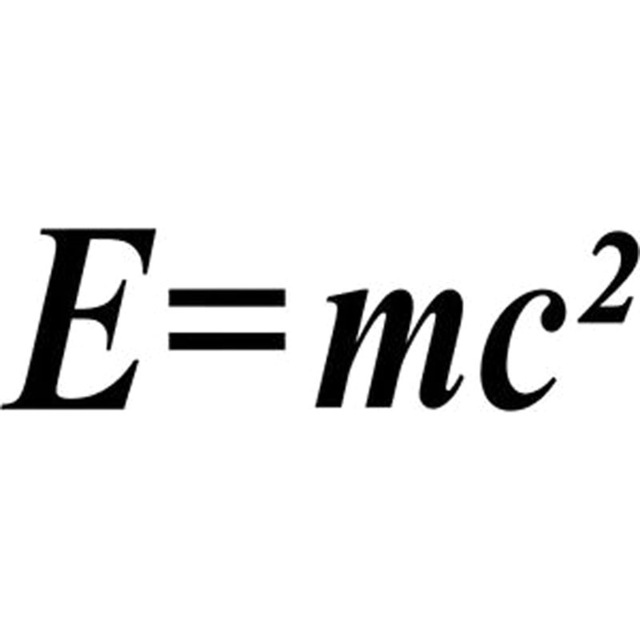
L'energia è uguale alla massa per la velocità della luce al quadrato. Questo vorrebbe dimostrare che la massa non scompare, ma, si trasforma in qualcos'altro: in materia
Essendo un'equazione se dividiamo E:c^2 e otteniamo la materia. Infatti, su questa base molti fisici hanno elaborato teorie sull'origine dell'Universo
Ipotesi di De Broglie
Louis-Victor Pierre Raymond de Broglie, comunemente chiamato Louis de Broglie,(1892 -1987), è stato un fisico e matematico francese.
Si impose all'attenzione del mondo scientifico con la sua tesi di dottorato, in cui espose le innovative teorie sul dualismo onda-particella della materia, aspetto fondamentale della meccanica quantistica, per il quale vinse il Premio Nobel per la fisica nel 1929.
De Broglie estese a qualsiasi particella elementare e all'elettrone in particolare il dualismo onda-corpuscolo enunciato da Einstein:

Dove v è la velocità di e; m la massa di e
Principio di indeterminazione di Heisemberg
Werner Karl Heisenberg (1901- 1976) è stato un fisico tedesco.
Premio Nobel per la fisica nel 1932, fu uno dei fondatori della meccanica quantistica.
Heisemberg dimostrò che non è possibile determinare simultaneamente la posizione e la velocità dell'elettrone. Non è possibile definire la traiettoria dell'elettrone, a differenza di quamto previsto da Bohr (traiettorie fisse)
Equazione di Schrodinger
Erwin Schrödinger ( 1887- 1961) è stato un fisico e matematico austriaco, di grande importanza per i contributi fondamentali alla meccanica quantistica e in particolare per l'equazione a lui intitolata, per la quale vinse il premio Nobel per la fisica nel 1933.
Il movimento degli elettroni avviene in tre dimensioni per cui le soluzioni accettabili dell'equazione d'onde derivano dalla combinazionde di tre costanti dette numeri quantici, indicati con le lettere n,l,m
Ogni funzione d'onda caratterizzata da tre numeri quantici viene chiamata orbitale e corrisponde ad uno stato stazionario possibile per l'elettrone:

-1 (n,l,m)
numero quantico principale n=1,2,3,4...
Numero quantico secondario o angolare l
l=0,1,2,3... (n-1)
n=1 l=0 l=0 orbitale s
n=2 l=0,1 l=1 orbitale p
n=3 l=0,1,2 l=2 orbitale d
l=3 orbitale f
(forma del volume di spazio occupato da e)
Numero quantico magnetico ml
ml= -1...o...1...
l=0 (orbitali s) ml= 0
l=1 (orbitali p) ml= -1, 0, 1
l=2 (orbitali d) ml= -2, -1, 0, 1, 2
Orientamento degli orbitali nello spazio
Orbitale atomico
Un orbitale atomico è definito da tre numeri quantici (n,l,ml) che formalmente sono una conseguenza matematica della soluzione dell'equazione di Schrodinger. L'elettrone è poi caratterizzato da un quarto numero quantico ms legato al moto di spin dell'elettrone (rotazione attorno all'asse)
ms= +1/2, -1/2
I diversi orbitali sono indicati con le seguenti lettere:
l s p d f g
0 1 2 3 4
Configurazione elettronica, principio dell'Aufbau
1) un orbitale può contenere al massimo 2 elettroni (principio di esclusione di Pauli), se vi sono due elettroni deve avere il numero di spin opposto (+1/2 ; -1/2), può essere vuoto o contenere un solo elettrone spaiato.
2) nel progressivo riempimento degli orbitali, l'elettrone va ad occupare l'orbitale disponibile avente più bassa energia.
3) orbitali degeneri (aventi la stessa energia) se vi sono più orbitali con uguale energia la configurazione più stabile è quella che porta alla massima molteplicità, cioè in cui gli elettroni si dispongono con spin parallelo e quindi in orbitali diversi.
Il carbonio
Il carbonio è l'elemento chimico della tavola periodica che ha come sibolo "C" e come numero atomico 6. é un elemento non metallico tetravalente, insolubile nei solventi, inodore e insapore. Inoltre ha una grande affinità per i legami chimici con atomi di altri elementi a basso peso atomico. Queste proprietà permettono l'esistenza di 10 milioni di composti del carbonio. L'isotopo più comune è quello del carbonio-12 (nucleo formato da 6 protoni e 6 neutroni), anche l'isotopo carbonio-14 è fondamentale ed è comunemente usato per la datazione radioattiva di antichi reperti.
Il carbonio ha 2 elettroni spaiati nel livello più esterno, poichè nei composti organici il C forma 4 legami covalenti, significa che un elettrone nell'orbitale 2s è promosso nell'orbitale 2p e poi si verifica l'ibridazione.
Ibridazione sp^3
Si ottiene dal rimescolamento dell'orbitale con 3 orbitali e i quattro orbitali ibridi, si dispongono ai vertici di un tetraedro con angolo di 109,5 gradi. I legami che formano con gli altri elementi sono di tipo sigma, perciò molto forti. é una combinazione matematica dei 4 orbitali 2s,2px,2py e 2p: per generare 4 orbitali equivalenti di natura ibrida. La sovtrapposizione di un ibrido sp^3 ed un 1s origina un legame sigma.
Ibridazione sp^2
Dopo la promozione dell'elettrone, un orbitale s si ibrida con 2 orbitali p, i 3 orbitali ibridi si dispongono sullo stesso piano con angolo di 120 gradi, mentre l'orbitale p non ibridato si pone perpendicolarmente agli altri 3. Quando si sovrappone un orbitale p non ibridato di un C con quello di un altro C, si ha un legame pi greco, più debole del legame sigma, quindi, tra due atomi di C si ha un doppio legame, uno sigma e uno pi greco.
Ibridazione sp
Si ha quando un orbitale s si sovrappone ad un solo orbitale p; i due orbitali ibridi ottenuti si dispongono lungo un asse con un angolo di 180 gradi. Gli orbitali p non ibridati si pongono perpendicolari tra loro e agli orbitali ibridi. Gli orbitali ibridi formano due legami sigma con altri elementi, mentre tra i due C si ha un triplo legame: uno sigma e due pi greco.
Isometria, Alcani
Gli isometri sono composti aventi la stessa formula, ma distribuiti in spazi diversi. Gli alcani sono idrocarburi che impiegano solo legami singoli (legami di tipo sigma). La formula generale degli alcani è: Cn H2n+2, dove n= 1,2,3,4... pertanto per n= 1CH4 (metano), per n= 5C5H6 (etano), per n=3 C3H8 (propano), per n= 4 C4H10 (butano), per n= 5 C5 H12 (pentano)... Gli alcani sono anche chiamati idrocarburi saturi, perchè per un dato numero di atomi di carbonio, contengono il più alto numero possibile di atomi di idrogeno. Il varbonio negli alcani ha sempre un'ibridazione sp^3 e sono presenti solo singoli legami, perciò la configurazione di questa classe di composti è quella tetraedrica (mentre per sp^2 è detta trigonale e per sp è detta digonale).
